4ºaño "INTRODUCCIÓN A LA QUÍMICA "
LAS LEYES DE LOS GASES
Bienvenidos!!
La ecuación de gases ideales tiene en cuenta procesos donde hay cambios de presión, cambios de temperatura, cambio en el volumen e incluso cambios en la cantidad de masa.
¿Qué es un gas ideal?
Un gas ideal o gas teórico es un conjunto de moléculas en estado gaseoso separadas separadas una de la otra de tal manera que no se ejerce fuerzas intermoleculares entre ellas.
La condición de gas ideal ocurre normalmente a bajas presiones y altas temperaturas lo que permite que cada partícula esté alejada una de la otra con el fin de que no interactúen.
Características de los gases ideales
- Todos los gases ideales están compuestos por átomos o moléculas
- Las moléculas del gas se mueven a altas velocidades
- Si dos moléculas chocan se genera un choque elástico, es decir que no hay pérdidas de energía
- Los gases ideales se dilatan, lo que significa que aumentan de volumen con los aumentos de temperatura
- Los gases ideales son adaptables, no tienen una forma definida sino que adaptan la forma del recipiente que los contiene
- En su gran mayoría, los gases ideales, son incoloros e inodoros, es decir no tienen ni color ni olor.
- Los gases ideales son compresibles, lo que significa que disminuyen el volumen a medida que la presión aumenta.
Ejemplos de gases ideales
- Aire
- Dióxido de carbono
- Monóxido de carbono
- Hidrógeno
- Nitrógeno
Explicación ley de gases ideales
En 1834 un ingeniero y físico francés llamado Émile Clapeyron dedujo por primera vez la ecuación de los gases ideales tomando como base el trabajo realizado por los científicos Boyle y Charles en sus respectivas ecuaciones.
La determinación de esta ley fue crucial ya que se conocían los comportamientos de un gas ideal en procesos que no cambiaban de masa (número de moles constante) pero hacía falta determinar cómo la cantidad variaba las condiciones como presión, temperatura y volumen.
Teniendo en cuenta los resultados obtenidos se pudo comprobar que la presión y el volumen eran directamente proporcionales a la temperatura y el número de moles, esto permitió conocer las diferentes variables a las cuales puede estar un gas.
De este modo se puede determinar que los gases ideales tienen un comportamiento predecible en cuanto a los cambios de presión y temperatura
Constante R
La constante R de los gases ideales es la relación que existe entre la presión, la temperatura, el volumen y el número de moles estándar para un gas, esta se obtiene a partir de la ecuación
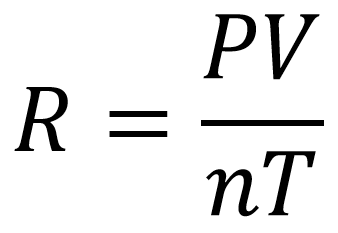
Las condiciones estándar para poder determinar la constante son:

Reemplazando los valores se tiene que
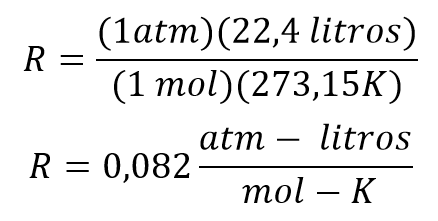
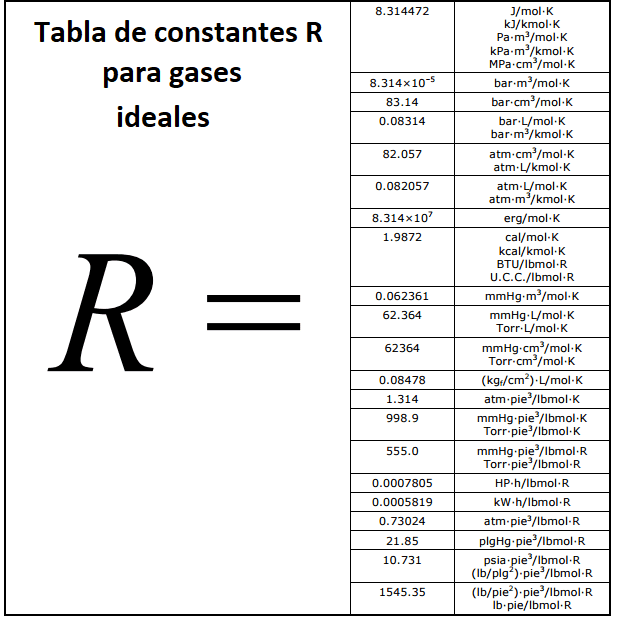
Una vez se tiene este principio se pueden determinar los valores de la constante R para diferentes unidades de presión, volumen y temperatura, de este modo se obtiene la tabla que se presenta a continuación
Procedimiento
1. Coloquen 100 ml de vinagre en una botella.
2. Coloquen una cucharadita de bicarbonato en un globo.
3. Sujeten el globo en la boca de la botella, con cuidado para que no se caiga el bicarbonato.
4. Levanten el globo y dejen que el bicarbonato entre en contacto con el vinagre.
5. Observen qué sucede con el globo a medida que va ocurriendo la reacción.
a)- Crear preguntas con los sucesos de la experiencia, ya que con esta se puedan responder.
b)- Elabora un PowerPoint con lo realizado en el punto 1 y el punto 1-a y adjuntarlo en comentarios.
2)-Hacer el siguiente cuestionario ingresando en el link que se les adjunta
https://edpuzzle.com/media/6154f071bd67d941232287b7
Luego de responder presiona el botón "SUBMIT" para ver si tu respuesta es correcta, y posteriormente presiona el botón "CONTINUE" para seguir con el cuestionario, para terminar subir a los comentarios la captura de pantalla para corroborar los resultados.


Comentarios
Publicar un comentario